|
依据《生物制品批签发管理办法》规定,疫苗类制品、血液制品、用于血源筛查的体外诊断试剂以及国家食品药品监督管理总局规定的其他生物制品,在每批产品上市销售前或进口时,都应当通过批签发审核检验。未通过批签发的产品,不得上市销售或进口。
国内的批签发检验机构有中国食品药品检定研究院(以下简称中检院)、北京市药品检验研究院、上海市食品药品检验研究院、广东省药品检验所、湖北省药品监督检验研究院、四川省食品药品检验检测院、吉林省药品检验研究院以及甘肃省药品检验研究院。
一、批签发业务范围
(一)各批签发机构承检范围
1.疫苗批签发:
中检院可独立签发全部疫苗品种。
北京市药品检验研究院等七个省级药品检验机构负责指定区域内企业疫苗产品的无菌及异常毒性等指定项目检验,并将结果报送中检院。
上海药品检验所除可进行上述提到的指定项目检验外,可独立签发指定区域内批签发申请人申报的流感疫苗。
2.血液制品批签发:
中检院可独立签发所有血液制品。
北京市药品检验研究院等七个省级药品检验机构可独立签发指定区域内企业的血液制品及从相应辖区口岸进口的人血白蛋白产品。
3.用于血源筛查的体外诊断试剂由中检院进行批签发。
(二)
七个省级药品检验机构所负责批签发管理辖区:
北京市药品检验研究院:北京市、天津市、河北省、山西省和内蒙古自治区
上海市食品药品检验研究院:上海市、山东省、江苏省、浙江省
吉林省药品检验研究院:黑龙江省、吉林省和辽宁省
湖北省药品监督检验研究院:湖北省、安徽省、江西省和河南省
广东省药品检验所:广东省、湖南省、福建省和海南省
四川省食品药品检验检测院:重庆市、四川省、云南省、贵州省、广西壮族自治区、西藏自治区
甘肃省药品检验研究院:陕西省、甘肃省、宁夏回族自治区、青海省和新疆维吾尔自治区
二、生物制品批签发流程及时限
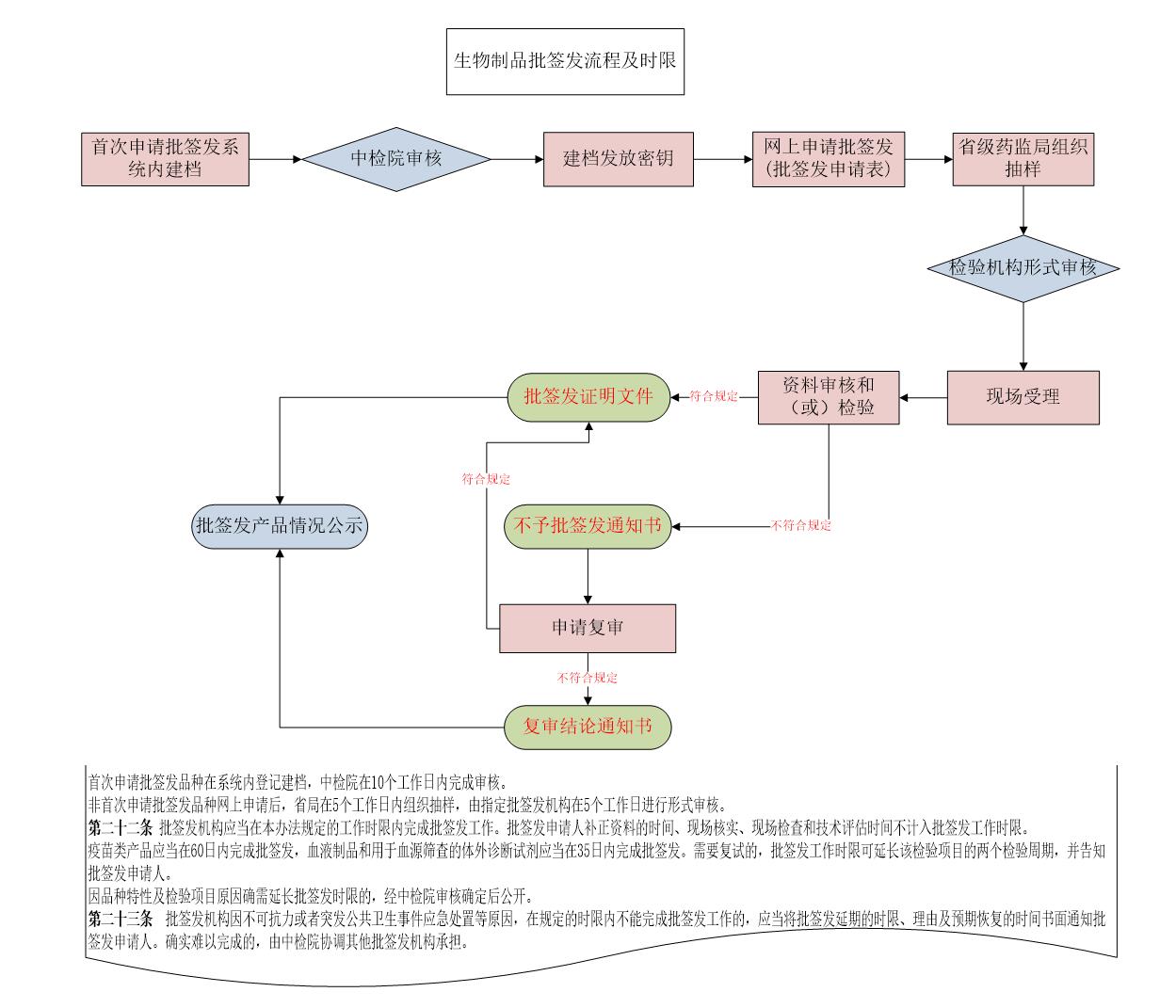
三、申请批签发应提交的资料
(一)新批准上市的生物制品首次申请批签发前,批签发申请人应当在批签信息管理系统内登记建档。需提交以下的资料:
1.生物制品批签发品种登记表;
2.药品批准证明文件;
3.合法生产的证明性文件。
(二)批签发申请人申请批签发时,应当提供以下证明性文件、资料及样品:
1.国产批签发
1) 生物制品批签发申请表(原件);
2) 生物制品批签发现场抽样记录表(原件);
3) 药品生产企业质量受权人签字并加盖企业公章的批生产及检定记录摘要或全套制检记录;
4) 药品批准证明文件;
5) 合法生产的证明性文件;
6) 上市后变更的批准证明性文件;
7) 数量满足相应品种批签发检验要求的同批号产品,必要时提供与检验相关的中间产品、标准物质、试剂等材料;
8) 质量受权人等关键人员变动情况的说明;
9) 与产品质量相关的其他资料。
2.进口批签发
1) 进口疫苗类制品和血液制品应当同时提交生产企业所在国家或者地区的原产地证明以及药品管理当局出具的批签发证明文件,并提供经公证的中文译本。
2) 进口产品在本国免予批签发的,应当提供免予批签发的证明性文件。
3) 进口药品报关的全套资料(包括:进口药品通关单、进品药品抽样记录单、进口药品口岸检验通知书。《进口药品注册证》或《医药产品注册证》。)
以上相关证明性文件为复印件的,应当加盖企业公章。
四、申请批签发对样品的要求
(一)品种要求(品种目录)
(二)数量要求(疫苗、血液类抽样数量、血源筛查诊断试剂抽样量)
特殊情况下经中检院事先确认,可酌情减量,但不得少于检验用两倍量。资料审核应提供一个包装单位的样品。
(三)样品状态要求:样品应包装完整,有完整标签,标签内容应符合国家局标签说明书相关文件规定。特殊情况,应符合有关规定。抽样样品应封签完整无损,签名或盖章清晰可辨。
(四)样品效期要求:样品剩余效期一般应满足2个检验周期,除特殊情况外(如进行稳定性考察等),已过效期或效期内不能满足2个检验周期的样品不予受理。
五、哪些情形未通过批签发及相关产品的处理?
(一)有下列情形之一的,批签发机构不予批签发,向批签发申请人出具生物制品不予批签发通知书,并抄送批签发申请人所在地省级食品药品监督管理部门:
1.资料审核不符合要求的;
2.样品检验不合格的;
3.现场检查发现违反药品生产质量管理规范、存在严重缺陷的;
4.现场检查发现产品存在系统性质量风险的;
5.批签发申请人无正当理由,未在规定时限内补正资料的;
6.其他不符合法律法规要求的。
(二)不予批签发的产品,由所在地省级食品药品监督管理部门按有关规定监督批签发申请人销毁。进口生物制品由口岸所在地食品药品监督管理部门监督销毁,或者退回境外厂商。批签发申请人应当将销毁记录同时报食品药品监督管理部门和相应的批签发机构。
六、批签发申请表下载(下载)
本“送检须知”依据现行《生物制品批签发管理办法》等管理文件起草,当国家有关文件修订时,我院将适时修订本须知。本须知中与上位规章不适宜处,按国家有关规定执行。
|